Moderna подала заявку в американские регулирующие органы с просьбой одобрить экстренное использование своей вакцины против COVID-19. Биотехнологическая компания подала заявку на основании клинических исследований, результаты которых показали, что вакцина эффективна в 94,1% случаев и не имеет серьезных проблем с безопасностью. Об этом написала The Wall Street Journal.
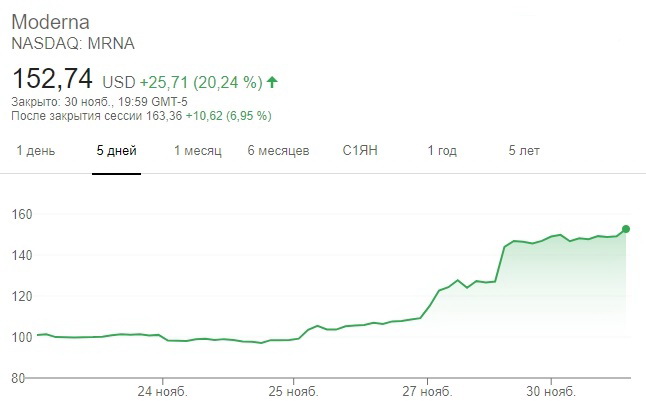
Акции Moderna выросли по итогам торгов 30 ноября на 20,24%, до $152,74 за акцию. Такого уровня котировки достигли впервые за всю историю компании. На постмаркете бумаги биотеха продолжили дорожать, прибавив еще 6,9%.
По информации WSJ, группа внешних экспертов соберется 17 декабря, чтобы обсудить, достаточно ли фактов в пользу одобрения вакцины. По итогам обсуждения эксперты решат, можно ли рекомендовать вакцину Управлению по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в качестве препарата для экстренного применения.
Если FDA одобрит вакцину, ее могут начать распространять в течение ближайших нескольких недель, пишет газета. Сейчас на рассмотрении регулятора уже находится вакцина, разработанная компанией Pfizer в сотрудничестве с BioNTech. Она показала эффективность в 95% случаев. Решение по вакцине Pfizer может быть принято на неделю раньше, так как компания подала заявку еще 20 ноября.
30 ноября Moderna выпустила пресс-релиз, в котором сообщила, что ее вакцина мРНК-1273 способна предотвращать болезнь в 94,1% случаев использования. При этом она на 100% эффективна против тяжелых форм COVID-19.
Испытания проходили 30 тыс. добровольцев. Коронавирусом заразились только 196 человек, 185 из них принимали плацебо, а 11 — реальную вакцину. У 30 добровольцев болезнь протекала в тяжелой форме — все они входили в группу плацебо. «Вакцина мРНК-1273 в целом хорошо переносится, и на сегодняшний день серьезных проблем с безопасностью не выявлено», — сказано в документе.