На повестке сектор биотехнологий. Разберем деятельность биотехнологических компаний, а именно, какие стадии они проходят при разработке продуктов и какие особенности присущи каждой стадии.
Для начала, обобщим, что биотехнологические компании занимаются разработкой новых продуктов и проведением клинических испытаний.
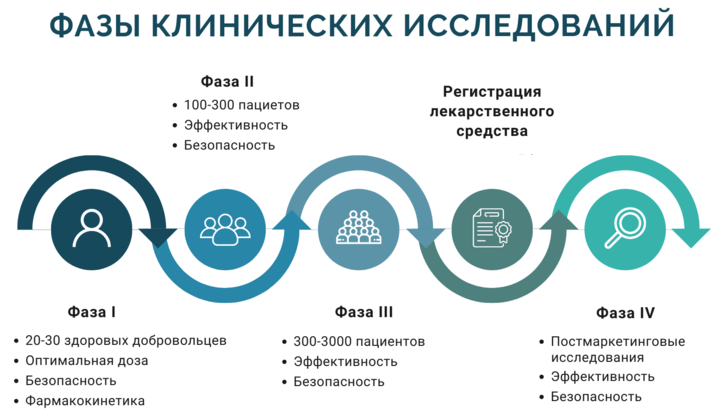
ФАЗЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ПРЕПАРАТА
Клинические исследования (clinical research) — стандартизированный процесс имплементации лекарственного препарата от стадии разработки до стадии розничных продаж.
Доклинические испытания
Здесь проводится доклиническое тестирование уже разработанного препарата на животных, чтобы собрать данные о его эффективности, негативном влиянии на организм и прочей фармакокинетической информации.
ФАЗА I
Получив препарат-кандидат, на этом этапе активное вещество начинают тестировать на небольших группах здоровых людей, добровольно согласившихся принять участие в исследовании.
Главная цель — понять, стоит ли продолжать работу с препаратом, и, по возможности, установить приемлемые дозы для использования у пациентов на II фазе.
В среднем, первую фазу успешно проходят примерно 70% компаний.
ФАЗА II
На второй фазе компания начинает базовое тестирование препарата на пациентах с заболеванием, для лечения которого его разрабатывали. Результаты базовых исследований в значительной степени могут повлиять на одобрение препарата.
Подразделяется на два этапа:
Этап IIa) Исследование проводится под строгим наблюдением за ограниченным числом пациентов (100-300 человек).
Главная цель — выявить эффективность препарата для лечения конкретного заболевания, оценить его безопасность, установить дозу и как от нее зависит эффект и т.д.
Этап IIb) Более обширные исследования на пациентах.
Главная цель — получить убедительные доказательства эффективности и безопасности препарата.
В среднем, вторую фазу успешно завершают около 33% компаний. При этом вторая фаза считается наиболее критическим моментом в создании нового препарата.
ФАЗА III
Здесь испытания проводятся на широких и, по возможности, разнообразных группах пациентов (1000-3000 человек).
Препарат тестируется для получения дополнительной информации о его безопасности и эффективности: частота нежелательных реакций, его взаимодействие с другими лекарствами, влияние возраста и патологий, оценивается его терапевтический эффект и т.д. Данные этой фазы станут основой для создания инструкции по применению.
В среднем, третью фазу с успехом завершают около 25-30% компаний.
ФАЗА IV
На последнем этапе для выпуска препарата в розничную продажу необходимо получить разрешение от FDA. При этом мониторинг долгосрочных эффектов препарата на этом не заканчивается.

ПРОЦЕСС ОДОБРЕНИЯ ПРЕПАРАТА
FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) — регулирующий орган, который утверждает новые лекарства для рынка США, а также разрешает клинические испытания на людях.
Инвесторы в биотехнологии должны понимать процесс одобрения. Компания подает официальный запрос на одобрение, называемый заявкой на новый лекарственный препарат (NDA) и оплачивает сбор за ее подачу. После получения заполненной заявки FDA назначает дату PDUFA (Prescription Drug User Fee Act). Это дата, к которой агентство вынесет решение по заявке.
Затем FDA рассматривает заявку и может созвать консультативный комитет. Это группа экспертов, которые рассматривают заявку и выносят заключение относительно того, следует ли одобрять лекарство на основе имеющейся в настоящее время информации.
Затем FDA оценивает заключение комиссии и принимает решение: либо предоставит разрешит компании продавать препарат, либо выпустит полное ответное письмо (CRL), равносильное отказу. Однако это не конец, компания может продолжить собирать данные и повторно подать заявку позже.
Когда инвесторы узнаю о решении FDA?
Когда FDA выпускает предлагаемое решение по какому-то вопросу, оно публикует его в Федеральном Реестре, чтобы общественность могла изучать его и отправлять замечания. FDA учитывает замечания, присланные в течение установленного периода обсуждения предлагаемого решения, а затем может изменить решение с учетом рассмотрения замечаний и выпустить окончательное решение. Предлагаемое и окончательное решения и поддерживающие документы размещаются в официальном онлайновом реестре FDA http://www.regulations.gov, а также на веб-странице www.fda.gov/fsma.
Влияние настроения FDA
Когда дело касается инвестирования в компании биотехнологического сектора, стоит обращать внимание и на «настроения» FDA. Оттого, консервативно оно настроено или либерально, зависит «жесткость» проверки соответствия требованиям. Если регулирующий орган занимает консервативную позицию, то первостепенное значение приобретают безопасность и чистота препарата. Поэтому сомнительные препараты могут не получить разрешения. Если FDA занимает более либеральную позицию, то проверка проводится более лояльно, некоторые из правил не применяются так строго, поэтому на рынок может выйти препарат, профиль соотношения риска и пользы которого выглядит сложнее. Особенно часто так получается с уникальными лекарствами, которые предназначены для лечения болезней с малым количеством вариантов лечения.
В завершении отметим, что у FDA есть аналоги в Европе и России. В Российской Федерации аналогичные мероприятия проводит Федеральная служба по надзору в сфере здравоохранения и социального развития, а в Европе это Европейское агентство лекарственных средств (EMA, European Medicines Agency).
Оставайтесь с нами, подписывайтесь на наши социальные сети, чтобы быть в курсе!Мы в телеграмм
Наши мобильные приложения:
